鸡源乳酸菌的分离鉴定
杜志琳 李雪平 尹望
(北京好实沃生物技术有限公司,北京101399)
摘 要:在本研究中,采用MRS培养基从健康AA肉鸡十二指肠、空肠、回肠及盲肠中分离获得11株乳酸菌,并对其进行形态观察、生理生化试验及16S rDNA序列同源性分析,最终确定所分离的菌株主要是5种乳酸杆菌(嗜酸乳杆菌R1、植物乳杆菌R2、鼠李糖乳杆菌R3、短乳杆菌R4、发酵乳杆菌R5)、4种肠球菌(盲肠肠球菌R9、粪肠球菌R8、R10、鸟肠球菌R7、屎肠球菌R6、R11)。
关键词:鸡源,乳酸菌,分离鉴定
畜禽养殖中抗生素的过度添加给人类和畜禽养殖带来了负面影响,如药物残留、超级细菌、环境污染、耐药性等问题,而人们对健康畜牧业和绿色食品也越来越关注,因此寻求一种有机无公害的饲料添加剂势在必行[1~4]。微生态制剂作为一种绿色添加剂出现,因其天然、无残留、无毒害安全可靠倍受关注,可直接进入动物肠道中,定植在动物肠道中,抑制外来病原菌的入侵,维持动物肠道平衡,促进动物对营养物质的吸收,增强免疫等[5],包括乳酸菌、芽孢杆菌、酵母及霉菌等,其中乳酸菌是动物肠道中的正常菌群之一,具有较强的粘附力,可定植在肠粘膜上,形成乳酸菌屏障[6~8]。乳酸菌有益于肠道内正常菌群生长,并能减少大肠杆菌和沙门菌等病原菌在肠道内的定植,从而达到清除肠道腐败菌及改善宿主胃肠道功能的作用,维护动物健康。因此,从动物肠道中分离获得的乳酸菌对肠道环境有较高的适应性,更易于在肠道中定植。来自同种动物肠道的乳酸菌更有利于发挥益生功能[9]。本试验健康AA肉鸡肠道中分离肠道乳酸菌,为禽用微生态制剂菌种的研发应用奠定基础。
1 材料
1.1 试验动物
试验选用30日龄健康AA肉鸡购自某散养户。
1.2 培养基
牛肉膏蛋白胨培养基、MRS培养基、MRS+碳酸钙培养基、牛肉膏蛋白胨培养基、淀粉水解培养基、糖醇发酵培养基、明胶液化培养基、VP试验培养基等生理生化培养基。
1.3 乳酸菌的分离
1.3.1 样品获得
无菌采集AA健康肉鸡的十二指肠、空肠、回肠及盲肠的肠道内容物分别置于于无菌离心管中,并加入10倍灭菌生理盐水,混匀,稀释至10-3倍。
1.3.2乳酸菌分离纯化
取不同部位的稀释液100μL分别于MRS培养基及MRS+碳酸钙培养基上涂布均匀,每个部位至少三个重复,37℃倒置培养24h-48h。挑取形态不同的菌落在MRS培养基上划线培养24h-48h,并于斜面上保藏备用。
1.4 乳酸菌鉴定
1.4.1形态鉴定及染色观察
观察MRS上菌落形态,并将纯化后获得的菌株进行革兰氏染色,通过油镜观察菌株的显微形态。
1.4.2生理生化鉴定
参照《常用细菌系统鉴定手册》[9]将分离获得的菌株进行各种糖发酵、接触酶、硝酸盐还原、明胶液化等试验,初步鉴定其种类。
1.4.3分子生物学鉴定
通过试剂盒提取分离获得的菌株基因组DNA。50μL PCR扩增体系包括引物F和R各2.0μL,Taq DNA聚合酶3U,10×Taq buffer5μL,Mg2+ (25mmoL/L)3μL,菌株基因组DNA2μL,加双蒸水至50μL。反应条件为:94℃预变性2min,94℃变性1min,56℃退火30s,72℃延伸1min,共30个循环,72℃温浴10min,4℃保持。反应结束后PCR产物进行琼脂糖凝胶电泳检测,观察结果,回收所得PCR产物,送生物工程(上海)有限公司进行DNA序列的测定,序列经BLAST比对初步鉴定种属,通过Mega软件构建系统发育进化树。
3 结果与分析
3.1形态特征及染色结果
11株乳酸菌疑似菌(命名为R1、R2、……、R11),菌落均呈白色,隆起,表面湿润且光滑,有光泽,边缘整齐。在含有碳酸钙的MRS培养基上菌落周围有透明荣钙圈。革兰氏染色均为阳性,球状或杆状,单个、成对或成链状排列,无芽孢。R1~R5为杆菌,R6~R11为球菌。
3.2生理生化鉴定
11株疑似乳酸菌的生理生化试验结果如表1所示,参照《常见细菌系统鉴定手册》可初步鉴定R1~R5为乳酸杆菌,R6~R11为肠球菌。
表1 疑似乳酸菌生理生化试验结果
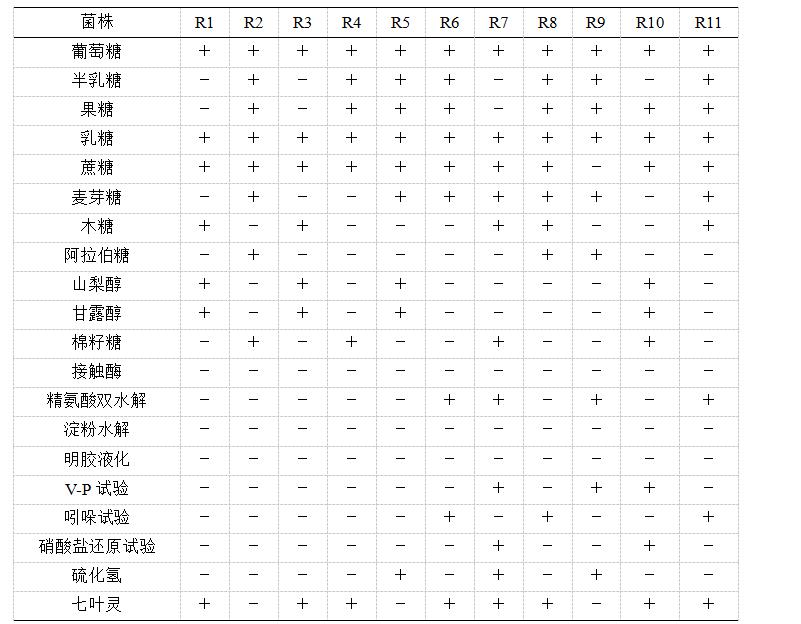
注:“+”表示反应阳性;“-”表示反应阴性
3.3分子鉴定结果
11株疑似菌株的16SrDNA PCR扩增产物大小均在1300~1500bp之间,琼脂糖凝胶电泳如图1所示。并将11株疑似菌株的16SrDNA序列进行BLAST同源性分析,发现R1与嗜酸乳杆菌序列同源性为99.7%,R2与植物乳杆菌序列同源性为99.6%,R3与鼠李糖乳杆菌序列同源性为99.5%,R4与短乳杆菌序列同源性为99.8%,R5与发酵乳杆菌序列同源性为99.7%,R6和R11与屎肠球菌序列同源性为99.6%,R7与鸟肠球菌序列同源性为99.8%,R8和R10与粪肠球菌序列同源性为99.6%,R9与盲肠肠球菌序列同源性为99.9%。
系统发育进化树如图2,R1与嗜酸乳杆菌EU878007位于同一支,R2与植物乳杆菌NR_115605位于同一支,R3与鼠李糖乳杆菌EF495247位于同一支,R4与短乳杆菌NR_044704位于同一支,R5与发酵乳杆菌FJ462686位于同一支,R6和R11与屎肠球菌KM186186位于同一支,R7与鸟肠球菌KR363182位于同一支,R8和R10与粪肠球菌EU887827位于同一支,R9与盲肠肠球菌NR_119291位于同一支。
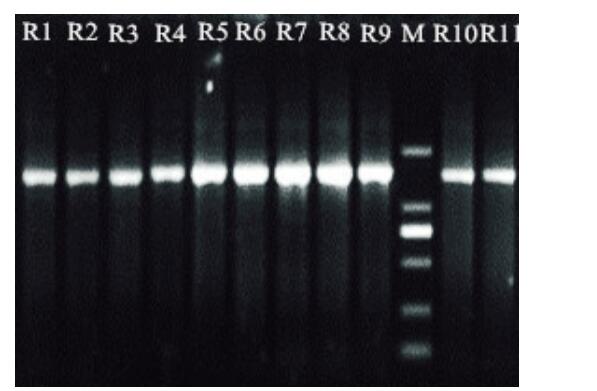
注:M为DL2000 ladder 条带由上之下分别为2000bp、100bp、750bp、500bp、250bp、100bp。
图1 11株分离菌的16SrDNA PCR扩增结果
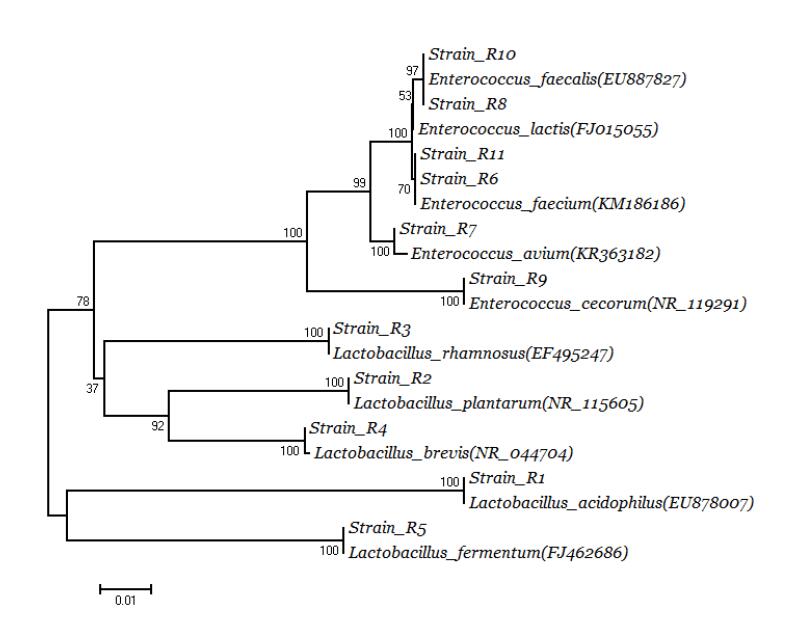
图2 11株分离菌的遗传系统发育进化树
4 讨论
乳酸菌制剂是一种新型微生态制剂,已经引起人们的关注,但是乳酸菌的应用效果不同,这主要与乳酸菌菌株的来源有关[11]。目前已有许多乳酸菌菌株是通过体外环境筛选获得的,与体内环境差异较大,来源于外界环境的乳酸菌不能耐受低pH和胆汁,且不易定植在肠壁上。许多研究者认为,理想的益生菌最好来自动物肠道[12]。因此本研究从健康肉鸡肠道的不同肠段分离乳酸菌,主要是基于肠道内乳酸菌的作用环境考虑,肠道中的有益菌已经经历过低pH的酸性环境和胆汁的影响,相对于其他部位的微生物而言,其耐酸性和耐胆盐性能较强。
多年来,人们鉴定乳酸菌主要采用常规鉴定方法[13],本研究采用了常规鉴定和16SrDNA两者结合的方法,从健康AA肉鸡肠道不同肠段中分离乳酸菌,通过对疑似菌株的形态观察、染色后显微形态观察、生理生化试验16SrDNA基因片段以及系统发育进化树分析,最终确定从健康AA肉鸡肠道中分离得到的11株益生菌,即5种乳酸杆菌(嗜酸乳杆菌R1、植物乳杆菌R2、鼠李糖乳杆菌R3、短乳杆菌R4、发酵乳杆菌R5)、4种肠球菌(盲肠肠球菌R9、粪肠球菌R8、R10、鸟肠球菌R7、屎肠球菌R6、R11)。
参考文献
[1] 王强,王慧.动物性食品抗生素残留的危害与解决对策[J].国外畜牧学-猪与禽,2009,29(5):87-89.
[2] 马永生,徐永平,金礼吉,等.饲用抗生素细菌耐药性的研究进展[J].中国饲料,2005,(12):5-7.
[3] 李爱科,林燕,赵永欣.饲用抗生素替代品研究进展[J].饲料工业,2013,(20):1-6.
[4] 刘世杰,宋代军,张家骅.滥用饲用抗生素的思考[J].畜牧与饲料科学,2004,25(2):14-16.
[5] 穆巍,阎宏,李静,等.微生态制剂的作用机理及其在畜禽生产中的应用[J].现代畜牧兽医,2007(5):70-72.
[6] 杨利娜,边高瑞,朱伟云.单胃动物肠道微生物菌群与肠道免疫功能的相互作用[J].微生物学报,2014,54(5):480-486.
[7] 张柏林,秦贵信,孙泽威,等.仔猪胃肠道微生物菌群定植规律及其功能的研究进展[J].中国畜牧杂志,2009,45(19):66-69.
[8] 凌泽春,郭立辉,任素芳,等.猪胃肠道微生物菌群的研究现状及调控技术进展[J].家畜生态学报,2011,32(5):5-9.
[9] 孔璨,胡晓阳,郭晓,等.SPF鸡肠道乳酸菌和肠球菌的分离鉴定与分布[J]. 中国家禽,2014,36(14):61-63.
[10] 东秀珠,蔡妙英,等.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[11] 王晶,季海峰,王四新,等.饲用乳酸菌制剂的研究现状及在养猪生产中的应用[J].中国畜牧兽医,2010,37(3):38-41.
[12] 魏萍,刘钊熠,田宗民.异源益生菌株抗病原体作用差异性比较[J]. 东北农业大学学报,2013,44(6):118-124.
[13] 段宇珩,谈重芳,王雁萍,等.乳酸菌鉴定方法在食品工业中的应用及研究进展[J]. 食品工业科技,2007,(2):242-244.



