一株猪源粪肠球菌 DT -02 的培养基优化
尹望 杜志琳 李雪平
(北京好实沃生物技术有限公司,北京 101399)
摘 要:在成功筛选到一株猪源粪肠球菌 DT -02 后,首先在 MRS 培养基的基础上对该菌进行培养基优 化。先进行单因素优化,后进行正交设计试验,最终得的最优培养基组合为葡萄糖3. 0%、蛋白胨 3. 0%、 MnSO4·H2O 0. 07 g/L、酵母粉1%、无水乙酸钠1. 4%、柠檬酸氢二铵0. 5%、MgSO4·7H2O 0. 2%、K2HPO4 0. 2%和吐温 -80 0. 4%。优化后的 MRS 培养基使摇瓶发酵活菌数提升了58. 79%。
关键词:粪肠球菌; 培养基优化; 单因素优化; 正交设计
肠球菌属是人和恒温脊椎动物肠道内的革兰阳 性菌,有着非常重要的医学意义。肠球菌广泛存在 于各种乳制品和发酵食品中,不仅能够影响食品的 风味和质地,还能产生乳酸、有机酸、乙醇、过氧 化氢、双乙酰和细菌素等许多抑菌物质。如一些肠 球菌素具有广谱抗菌作用。粪肠球菌作为肠球菌属 最常见的一种,现已作为益生菌和发酵剂广泛用于 微生态制剂、保健食品及发酵食品的工业生产中。 文章通过单因素优化及正交设计对一株猪源粪肠球 菌进行了培养基优化,为该菌应用于微生态制剂提 供理论基础。
1 材料与方法
1.1 菌种
DT -02,由北京好实沃生物技术有限公司试验 室保藏的一株筛选自仔猪肠道的粪肠球菌,在常规 MRS 培养基上培养。
1.2 培养基
种子培养基: 牛肉膏10、酵母粉5、蛋白胨10、 葡萄糖5、柠檬酸氢二铵 2、无水乙酸钠 5、K2HPO4 2、MnSO4·H2O 0. 05 和 MgSO4·7H2O 0. 2 g/L 及吐温 -80 1 ml/L,pH 6. 8。
MRS 固体培养基: 牛肉膏 10、酵母膏 5、葡萄 糖 20、无水乙酸钠 5、柠檬酸氢二铵 2、MnSO4 · H2O 0. 05、K2HPO4 2、MgSO4·7H2O 0. 2 和琼脂粉 18 g/L,吐温 -80 1 ml/L,pH 6. 8。
MRS 液体培养基: 牛肉膏 10、酵母粉 5、葡萄 糖 20、无水乙酸钠 5、柠檬酸氢二铵 2、K2 HPO4 2、MnSO4 ·H2 O 0. 05 和 MgSO4 ·7H2 O 0. 2 g/L, 吐温 -80 1 ml/L,pH 6. 8。
1.3 生长曲线的绘制
取粪肠球菌 DT - 02 于 MRS 平板上活化两代, 活化完成后于MRS 斜面划线,37 ℃培养24 h。取2 管斜面,分别用 2 mL 0. 9% 氯化钠溶液将菌苔洗 脱。取1 mL 菌液接种于液体 MRS 培养基,摇匀, 取0 h 的样品后于 37 ℃,180 r/min 条件下恒温摇 瓶培养16 h。每1 h 取一次样并立即进行活菌计数, 计数方法采用固体 MRS 倾注法。
1.4 培养基优化
1.4.1 碳源及其添加量的选择
选取葡萄糖、蔗糖、乳糖、糖蜜和可溶性淀粉 作为碳源,以2%的添加量取代 MRS 培养基中的碳 源。37 ℃,180 r/min,培养16 h 后进行活菌计数, 计数方法采用固体 MRS 倾注法。最佳碳源选定后,按照1. 0%、2. 0%、3. 0%、4. 0% 和 5. 0% 的添加 量加入到 MRS 培养基中,培养 16 h 后进行活菌 计数。
1.4.2 氮源及其添加量的筛选
选择硝酸铵、硝酸钠、尿素、硫酸铵、硝酸 钾、氯化铵、牛肉膏、蛋白胨、牛肉膏和蛋白胨组 合 ( 1∶1) 取代 MRS 中的氮源,添加量按照 MRS 培 养基中氮含量及以上各种氮源含氮量来折算。37 ℃, 180 r/min 条件下培养16 h 后进行活菌计数。
1.4.3 无机盐和生长因子及其添加量的筛选
确定最优碳源和氮源后,以最优碳源和氮源作 为培养基的碳源和氮源,将 MRS 中的无水乙酸钠、 柠檬酸氢二铵、K2 HPO4、MnSO4 ·H2 O、MgSO4 · 7H2O 和吐温 - 80 分别单独加入培养基中,通过测 定16 h 活菌数得出各种无机盐及生长因子对粪肠球 菌生长的相关性。根据各种无机盐和生长因子对粪 肠球菌生长影响的大小,对其添加量进行筛选。
1.5 正交试验
在单因素试验的基础上,确定了碳源、氮源及 无机盐中 MnSO4对 DT - 02 生长影响较大,因此正 交设计选取葡萄糖、蛋白胨和 MnSO43 个因素,进 行3 因素3 水平正交试验设计。
1.6 统计分析
用Excel 将不同培养基成分对DT -02 的活菌数 的影响进行整理与分析。
2 结果与分析
2.1 粪肠球菌 DT -02 生长曲线的绘制
从图1 可见: 粪肠球菌的生物量在1 ~2 h 没有 明显的变化,pH 保持在 6. 8 左右,此时粪肠球菌 处在迟缓期。2 ~7 h,菌体呈对数增长趋势,8 h 以 后生长缓慢,10 h 后进入稳定期,活菌数基本稳 定。17 h 后活菌数略有下降,可能是由于一部分菌 体开始自溶。pH 的变化曲线与粪肠球菌的生长曲线基本吻合,是由于粪肠球菌在生长过程中不断产生乳 酸所致,所以对数期内 pH 急剧下降。随着培养时 间的延长,pH 下降幅度逐渐减小,10 h 后 pH 基本 保持不变。粪肠球菌在培养过程中不断受到自身发 酵产物———乳酸的抑制,因此 pH 的下降幅度会逐 渐减小。
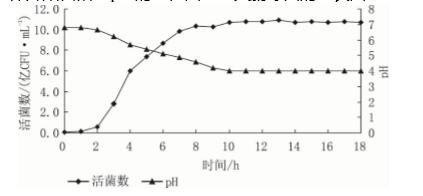
图1 粪肠球菌 DT -02 生长曲线和 pH 变化曲线
2.2 不同碳源对粪肠球菌活菌数的影响
从图2 可见: 粪肠球菌的最佳碳源为葡萄糖, 其次为乳糖和蔗糖,再次为糖蜜。淀粉不能被粪肠 球菌很好的利用,淀粉是多糖,可能是因为乳酸菌 在生长过程中缺少淀粉酶,不能把淀粉水解为单 糖,因此对淀粉的利用效率极低。而葡萄糖作为碳 源对粪肠球菌的生长促进效果最为明显,因为葡萄 糖是单糖,属于速效利用碳源,能够被粪肠球菌直 接利用,迅速提高其生物量。
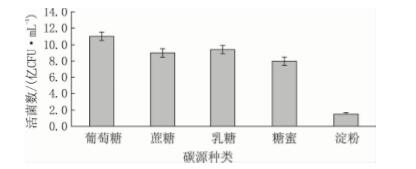
图2 不同碳源对粪肠球菌 DT -02 活菌数的影响
2.3 葡萄糖的最佳添加量筛选
从图3 可见: 随着葡萄糖添加量的加大,粪肠 球菌的生物量在一定范围内也逐渐增大,当添加 量达到 3. 0%时,活菌数最高; 超过 3. 0% 再增加 葡萄糖的量,活菌数不但不增加,反而呈下降趋 势,可能是因为糖质量浓度过高导致渗透压较高, 菌体生长受到抑制。因此,葡萄糖的最佳添加量 为3. 0%。

图3 葡萄糖添加量对粪肠球菌 DT -02 活菌数的影响
2.4 不同氮源对粪肠球菌活菌数的影响 从图4 可见: 粪肠球菌对无机氮源的利用率较 低,能够有效促进其生长的是牛肉膏和蛋白胨,属 于有机氮源。这是因为粪肠球菌合成蛋白的能力较差,不易利用无机氮源,而有机氮源中含有丰富的 氨基酸,较容易被吸收利用。单独使用蛋白胨和混 合牛肉膏使用效果相近,且牛肉膏的成本较高,因 此为降低生产成本,选用蛋白胨作为粪肠球菌的 氮源。
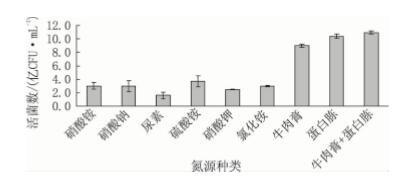
图4 不同氮源对粪肠球菌 DT -02 活菌数的影响
2.5 蛋白胨的最佳添加量筛选
从图 5 可见: 确定最佳氮源后,选取蛋白胨 的添加量分别为 1. 0% 、2. 0% 、3. 0% 、4. 0% 和 5. 0%,培养 14 h 后,进行活菌计数。粪肠球菌 的生物量随着蛋白胨的添加量的增加而上升,到 3. 0% 处出现拐点,因此蛋白胨的最佳添加量 为 3. 0% 。

图5 蛋白胨添加量对粪肠球菌 DT -02 活菌数的影响
2.6 不同无机盐和生长因子对粪肠球菌活菌数的影响
从图6 可见: 以葡萄糖和蛋白胨作为基础培养 基,分别向其中单独加入无水乙酸钠、柠檬酸二 铵、K2HPO4、吐温 -80、MnSO4·H2O 和 MgSO4· 7 H2O 进行试验,以不加无机盐和生长因子的基础 培养基作为对照组。添加无水乙酸钠、柠檬酸二铵、吐温 -80 和 MnSO4·H2O 对粪肠球菌的生长有 促进作用。其中,MnSO4 ·H2 O 的促进作用最明 显,其次为无水乙酸钠。而 K2HPO4 和 MgSO4 ·7 H2O 对粪肠球菌生长的促进作用不明显。

图6 不同无机盐对粪肠球菌 DT -02 活菌数的影响
2.6.1 MnSO4·H2O 添加量的筛选
从图7 可见: 以葡萄糖和蛋白胨为基础培养基, 向其中分别加入 0. 05、0. 10、0. 15、0. 20、0. 25 和 0. 30 g/L 的MnSO4·H2O,以不加MnSO4·H2O 的基 础培养基作对照。基础培养基中加入0. 05 g/L 的 MnSO4·H2O 能够明显提高粪肠球菌的生物量,超 过1. 0 g/L 后促进用略有降低。因此,MnSO4·H2O 的最佳添加量为0. 05 g/L。
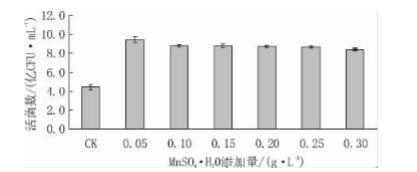
图7 MnSO4·H2O 添加量对粪肠球菌 DT -02 活菌数的影响
2.6.2 无水乙酸钠添加量的筛选
从图8 可见: 以葡萄糖、蛋白胨和 MnSO4·H2O ( 0. 05 g/L) 作为基础培养基,分别加入 0. 2%、 0. 4%、0. 8%、1. 0%、1. 2%、1. 4%和 1. 6%的无 水乙酸钠,以不添加无水乙酸钠的基础培养基作对 照。培养基中加入少量无水乙酸钠可以提高粪肠球 菌的生物量,随着无水乙酸钠的添加量的增加,粪 肠球菌的生物量逐渐增高,在 1. 4% 处出现拐点, 因此无水乙酸钠的最佳添加量为1. 4%。
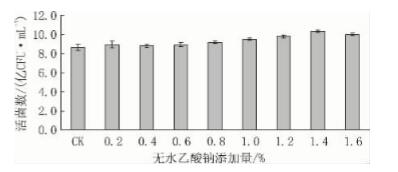
图8 无水乙酸钠添加量对粪肠球菌 DT -02 活菌数的影响
2.6.3 柠檬酸氢二铵添加量的筛选
从图9 可见: 以葡萄糖、蛋白胨、MnSO4·H2O ( 0. 05 g/L) 和无水乙酸钠 ( 1. 4%) 为基础培养 基,分别向其中加入 0. 1%、0. 2%、0. 3%、 0. 4%、0. 5%、0. 6%和0. 7%的柠檬酸氢二铵。柠 檬酸氢二铵的质量浓度在 0. 5% 以下时,粪肠球菌的生物量随柠檬酸二铵添加量的增加而增加,超过 0. 5%时,粪肠球菌的生物量会逐渐下降。可能是 因为柠檬酸氢二铵对粪肠球菌的糖代谢途径的关键 酶———磷酸果糖激酶有调节作用,柠檬酸对磷酸果 糖激酶有抑制作用,而适当质量浓度的铵根离子 ( NH4 + ) 可以解除这种抑制作用。因此,柠檬酸二 铵的最佳添加量为0. 5%。
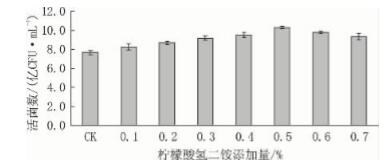
图9 柠檬酸氢二铵添加量对粪肠球菌 DT -02 活菌数的影响
2.6.4 吐温 -80 添加量的筛选
从图10 可见: 吐温 - 80 是聚氧乙烯脱水山梨 醇单油酸酯,简称聚山梨酯 - 80,通常作为乳化剂 和分散剂,一方面能够使培养基中的营养成分更加 均匀,另一方面它是一种刺激因子,能够在一定程 度上促进乳酸菌的生长。吐温 - 80 的最佳添加量 是0. 40%。
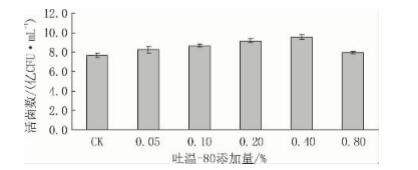
图11 酵母浸粉添加量对粪肠球菌 DT -02 活菌数的影响
2.8 正交试验 正交设计表见表1,试验结果见表2。
表1 正交设计表
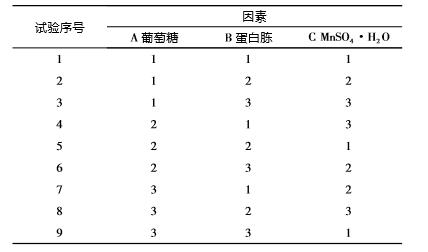
表2 正交设计试验结果
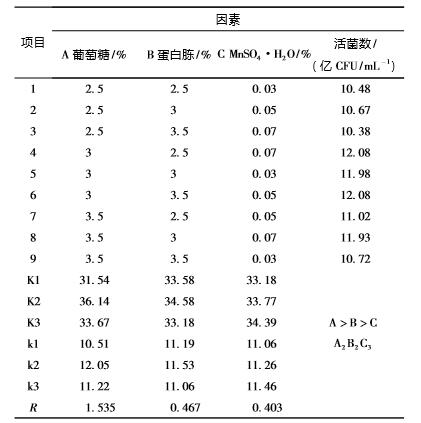
从表2 可见: 通过 3 种因素的 R 值来看,3 种 影响因素对粪肠球菌活菌数的影响大小排序为 A > B > C。根据 k 值可以确定,最佳组合为 A2 B2 C3, 即葡萄糖、蛋白胨和 MnSO4 ·H2 O 的添加量分别为 3. 0%、3. 0%和0. 07 g/L。
因此,最优培养基组合为葡萄糖3. 0%、蛋白 胨3. 0%、MnSO4 ·H2 O 0. 07 g/L、酵母粉 1. 0%、 无水乙酸钠 1. 4%、柠檬酸氢二铵0. 5%、MgSO4· 7H2O 0. 2%、K2HPO4 0. 2%和吐温 -80 0. 4%。
使用优化后的培养基再次进行粪肠球菌 DT - 02 的生长曲线测定,结果如图 12 所示。在优化后 的培养基中,菌体在对数期繁殖更
迅速,16 h 的活菌数为 16. 99 亿 CFU/mL,与初始 的 MRS 培养基相比提高了58. 79%。
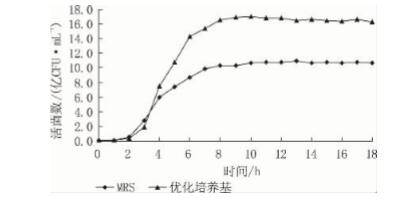
图12 2 种不同培养基中粪肠球菌 DT -02 的生长曲线
3 讨论与结论
粪肠球菌是链球菌科肠球菌属的一种,是人类 和动物肠道中正常菌群的一部分,广泛分布于自然 界中。利用无毒害及兼性厌氧菌的粪肠球菌配合枯 草芽孢杆菌和酵母菌等益生菌制成微生态制剂 ( AMEA) ,可调节动物肠道平衡,减少多种消化道 疾病的发病率,有望代替抗生素的使用。
研究对一株猪源粪肠球菌 DT - 02 进行了培养 基优化,提高了摇瓶发酵活菌数,为提高发酵生产 效率,降低生产成本提供了一些理论基础。
参考文献
[1] Duc L H,Hong H A,Barbosa T M,et al. Characterization of bacillus probiotics available for human use[ J] . Appl. Enviro. Microbiol. ,2004, 70(4) :
2161 -2171.
[2]董懿樱,陈臣,任婧,等. 乳酸菌对肠免疫调节功能 研究进展[ J] . 中国微生态学杂志, 2014, 26(2) : 221 -224, 242. [3]王蔚淼,张家学,齐振雄. 乳酸菌类微生态制剂在饲 料中的应用[ J] . 饲料博览:技术版, 2008(7) :8 -11.
[4]姜云,尹望,陈长卿, 等. 人参内生颉颃细菌 NJ13 的 鉴定及发酵条件[ J] . 农药, 2013, 52(2) :97 -101.
[5]魏姗姗,马红霞,高云航,等. 猪源益生枯草芽孢杆 菌的分离鉴定及培养条件优化[ J] . 中国饲料, 2014(5) :21 -25, 28. [6]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M] . 北 京:科学出版社, 2001.
[7]马妙莲,赵静,陈晓琳,等. 具有广谱抑菌活性乳酸 菌的筛选及抑菌物质分析[ J] . 食品科学, 2012, 33 (1) :162 -165. [8]杭柏林,胡建和,刘丽艳,等. 乳酸菌株植物乳杆菌 和粪链球菌对肉鸡免疫性能的影响[ J] . 广东农业 科学, 2008(11) :80 -83.
[9] Dacachel M A. Antimicrobial substances from lactic acid bacteria for use as food preservatives[ J] . Food Technol. , l989(43) :164.



